Negli ultimi anni, l’introduzione di due nuovi farmaci ha cambiato la gestione dei pazienti con porpora trombotica trombocitopenica immune. Una recente review spiega i principali interrogativi che i medici si ritrovano ad affrontare nella pratica clinica.
Da circa una decina di anni anche i farmaci caplacizumab e il rituximab sono disponibili per la cura dei pazienti con la porpora trombotica trombocitopenica immune (iPTT), una patologia rara che causa la formazione di trombi e conseguenti danni ischemici, in particolare del cuore, del cervello e dell’intestino. In questi anni, i due medicinali sono stati somministrati in aggiunta alla terapia tradizionale con buoni risultati, ma hanno anche sollevato numerosi interrogativi sul modo di gestire al meglio i pazienti con questa patologia. Per facilitare la discussione a riguardo e delineare possibili soluzioni, un gruppo di medici del Dipartimento di Ematologia dell’Università Sapienza di Roma ha riassunto le questioni principali in una revisione della letteratura pubblicata sul Mediterranean Journal of Hematology and Infectious Diseases.
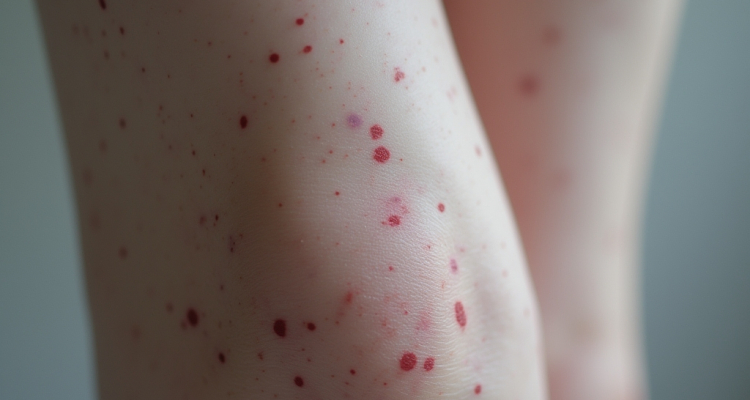
La porpora trombotica trombocitopenica immune è causata dalla produzione di anticorpi che causano una carenza della proteasi plasmatica ADAMST13, in grado di frammentare i complessi proteici del fattore di von Willebrand. Un’attività di questo enzima minore del 10% rispetto alla norma induce dunque l’accumulo di grandi multimeri del fattore di von Willebrand nel circolo sanguigno, che sono responsabili della comparsa di trombi e ischemie.
In genere, la terapia di riferimento per la porpora trombotica trombocitopenica immune comprende la plasmaferesi, una procedura che attraverso uno strumento che permette la separazione dei componenti del sangue “aferesi”, rimuove gli anticorpi contro ADAMTS13 e ristabilisce i livelli normali dell’enzima. Si continua poi con la terapia steroidea, che sopprime l’attività del sistema immunitario, e il caplacizumab, un anticorpo sviluppato per impedire l’aggregazione piastrinica con il fattore di von Willebrand. Il rituximab viene invece somministrato in caso di recidiva o refrattarietà, come seconda linea di terapia.
L’articolo di revisione inizia con la descrizione di un uomo di 70 anni ospedalizzato in stato di confusione e difficoltà nel parlare dovuto a lesioni neurologiche, che con esami più specifici è risultato essere affetto da porpora trombotica trombocitopenica immune. “Abbiamo deciso di riportare questo caso perché presenta degli spunti sulla gestione del trattamento di questa patologia che non rientrano nelle linee guida”, spiega Silvia Trisolini, prima autrice dell’articolo. Dopo aver iniziato a somministrare al paziente la terapia standard insorgono infatti i primi dubbi. In passato la conta delle piastrine era l’esame di riferimento per misurare quante plasmaferesi bisognasse effettuare e per capire la risposta dei pazienti alla terapia. Tuttavia, la conta piastrinica non ha più lo stesso valore clinico da quando è stato introdotto il caplacizumab. Il farmaco porta a una rapida normalizzazione dei livelli delle piastrine, in modo indipendente al processo di auto-immunità, rendendo di fatto il test inefficace.
“Al momento, il numero di plasmaferesi da eseguire dopo la normalizzazione della conta piastrinica è arbitrario” dice Trisolini. “Allo stesso modo, non esiste un momento preciso per somministrare il rituximab in aggiunta al caplacizumab”.
Servirebbero quindi nuovi parametri che considerino anche il processo di auto-immunità dei pazienti per monitorare la risposta alle terapie e gestire al meglio il percorso clinico. Livelli di attività di ADAMTS13 inferiori a 10IU/L potrebbe essere un’alternativa, come è stato anche proposto dall’International Working Group per la porpora trombotica trombocitopenica.
“Non potendoci più basare sulla conta delle piastrine dobbiamo considerare i valori di attività dell’enzima ADAMTS13 e il titolo degli anticorpi circolanti”, commenta Trisolini. Tuttavia, perché questi valori possano essere inclusi nelle linee guida, dovranno essere supportati e validati con ulteriori studi, che limitino anche il rischio di indurre effetti collaterali nei pazienti.
Combinare il rituximab con la terapia steroidea può per esempio esporre il paziente alla riattivazione di virus, quali il citomegalovirus, o a ulteriori complicazioni, come le infezioni opportunistiche”.
L’articolo originale è disponibile al seguente link: http://dx.doi.org/10.4084/MJHID.2024.060