Due studi pubblicati su Nature hanno analizzato l’emopoiesi e le mutazioni che si accumulano nel DNA delle cellule staminali emopoietiche nell’arco della vita dell’essere umano permettendo di fare passi avanti verso la comprensione delle dinamiche dell’invecchiamento. L’emopoiesi clonale sarebbe alla base delle variazioni fisiopatologiche che avvengono con l’avanzare dell’età, come la riduzione del numero delle cellule del sangue (citopenia) o l’aumento del rischio di sviluppare tumori ematologici.
Nonostante i progressi in ambito medico avvenuti nell’ultimo secolo abbiano permesso di prolungare l’aspettativa di vita europea oltre gli 80 anni, si continua ad assistere a un più rapido decadimento funzionale del corpo umano e a un aumento drastico della mortalità a partire dai 70 anni. Le ragioni di tale fenomeno sono in generale poco chiare ma gruppi di ricerca di diversi ambiti clinici stanno lavorando per comprenderle a fondo.
Per quanto riguarda l’ambito ematologico, due gruppi di ricerca inglesi del Wellcome Sanger Institute hanno cercato di fare chiarezza sulla relazione tra mutazioni che si riscontrano nelle cellule staminali emopoietiche e invecchiamento.
L’emopoiesi e l’insorgenza delle mutazioni nelle cellule staminali emopoietiche
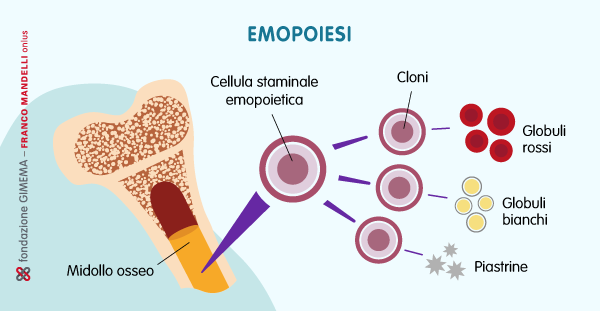
Le cellule del sangue vengono prodotte nel midollo osseo e originano dalle cellule staminali emopoietiche (HSC — Hematopoietic Stem Cells) grazie a un processo chiamato emopoiesi. Le HSC producono cellule figlie (cloni) che potenzialmente possono diventare qualsiasi cellula del sangue ma durante l’emopoiesi intervengono molecole che indirizzano la differenziazione dei cloni in diverse linee cellulari fino a farli diventare globuli rossi, globuli bianchi e piastrine.
Una volta prodotte, le cellule del sangue entrano in circolo ma, data la loro breve durata di vita (da poche ore di alcuni tipi di globuli bianchi ai 120 giorni dei globuli rossi), devono essere continuamente rimpiazzate. Per questo motivo, nel midollo osseo viene prodotta una grande quantità di cellule, circa 2 milioni al secondo. Più cellule vengono prodotte, però, più aumenta la probabilità che durante la replicazione cellulare insorgano mutazioni nel DNA.
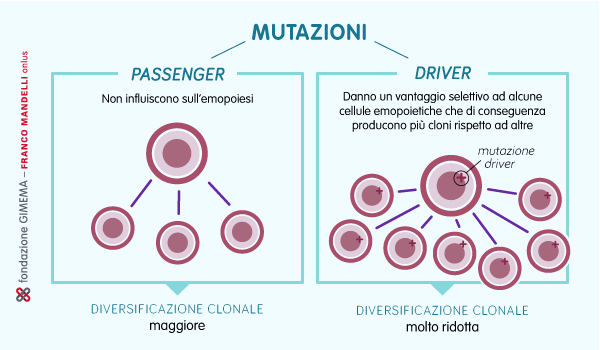
È stato stimato che si accumulino in media 17 mutazioni all’anno durante tutto l’arco della vita. La maggior parte di queste mutazioni sono dette passenger perché non influiscono sull’emopoiesi altre, invece, le mutazioni driver, danno un vantaggio selettivo ad alcune cellule emopoietiche che di conseguenza producono più cloni rispetto ad altre, dando inizio alla loro espansione clonale.
Le dinamiche dell’emopoiesi clonale
Come ogni persona ha cicatrici diverse e uniche che permettono di distinguerla da un’altra e ogni cicatrice ricorda un evento della vita in cui si è formata, così le cellule staminali emopoietiche hanno un set unico di mutazioni che aiuta i ricercatori a distinguere tra loro i cloni e a capire in quali momenti sono insorte.
Il gruppo di ricerca guidato da Emily Mitchel ha sequenziato 3759 genomi di cloni originati dalle HSC di 10 soggetti di età compresa tra 0 e 81 anni. Con i dati raccolti i ricercatori hanno costituito degli alberi filogenetici dove il tronco rappresenta la cellula staminale emopoietica, ogni biforcazione il momento in cui è stata acquisita una mutazione e ogni ramo un clone con una mutazione diversa.
È emerso che l’emopoiesi nei soggetti al di sotto dei 65 anni è massivamente policlonale. Significa che nel midollo osseo c’è una quantità elevata di cellule staminali emopoietiche, tra 20.000 e 200.000, e ognuna di essa dà origine a cloni che differiscono dagli altri contribuendo a creare un’elevata diversificazione nelle cellule del sangue.
L’emopoiesi nei soggetti con più di 75 anni, invece, mostra una diversificazione clonale molto ridotta. Nei pazienti anziani, infatti, tra il 3 e il 60% dell’intera produzione di cellule del sangue è dovuta a soli 12-18 cloni indipendenti.
Questo fenomeno è detto emopoiesi clonale ed è alla base dello sviluppo di alcuni tumori del sangue come le leucemie. Avviene perché le cellule che hanno subito mutazioni driver, ovvero vantaggiose, iniziano a produrre più cloni che prendono via via il sopravvento sulle altre cellule del midollo osseo determinando una riduzione della loro produzione e differenziazione, riducendo di conseguenza la policlonalità, fondamentale per un’ottimale fisiologia del sangue.
Mitchel et al. studiando il genoma dei cloni originati dalle cellule staminali emopoietiche sono riusciti a risalire alla storia della loro espansione ed è risultato che la maggior parte dei cloni ha iniziato a espandersi quando i soggetti avevano meno di 40 anni.
Il secondo studio condotto dal gruppo di ricerca guidato da Margarete A. Fabre ha analizzato le dinamiche dell’ematopoiesi clonale in 385 individui di età compresa tra i 54 e i 93 anni, partendo da 5 campioni di sangue raccolti da ogni partecipante nel corso di 13 anni per un totale di 697 cloni cellulari.
ll 92,4% dei cloni si è espanso a un tasso esponenzialmente stabile durante il periodo di osservazione ma il tasso di crescita era diverso a seconda delle diverse mutazioni driver. Alcuni cloni, quelli con mutazioni dei geni DNMT3A e TP53, si espandevano del 5% all’anno mentre altri, con mutazioni del gene SRSF2, arrivavano ad aumentare anche del 55% all’anno.
Inoltre, è emerso che le mutazioni che causano un tasso di espansione maggiore sono quelle correlate più frequentemente all’insorgenza di tumori maligni del sangue.
Nonostante i loro limiti dovuti soprattutto al campione ridotto di soggetti presi in esame, i risultati di questi due studi combinati hanno permesso di compiere passi avanti verso la comprensione dei fenomeni fisiopatologici che colpiscono la produzione del sangue con l’invecchiamento. Si è osservato che l’emopoiesi clonale rappresenta la norma nei soggetti anziani — e non l’eccezione — spiegando il motivo per cui, raggiunta una certa età, si assiste a un aumento drastico del rischio di sviluppare tumori ematologici, citopenie (carenza di cellule del sangue come l’anemia) e disfunzioni del sistema immunitario.