Questa storia inizia nel 1984, Apple presentava al mondo il suo primo computer mentre alcuni ricercatori identificavano una traslocazione cromosomica in cellule di Linfoma non-Hodgkin [t(14;18)]. A 32 anni da quella prima osservazione la ricerca è riuscita a produrre una molecola in grado di contrastare una delle caratteristiche fondamentali di una cellula tumorale: la resistenza all’apoptosi, la morte cellulare programmata.
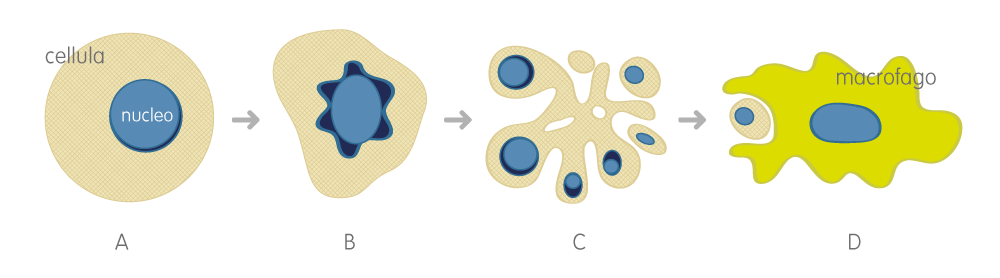
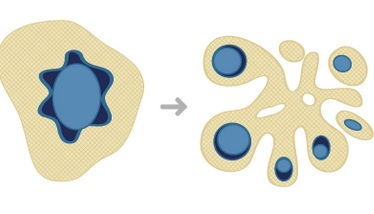
L’apoptosi è un meccanismo biologico di controllo. Se una cellula è daneggiata avvia una sorta di programma di auto distruzione onde evitare danni a livello sistemico. Il processo fa sì che la cellula si disgreghi (A, B, C) e che i residui vengano poi fagocitati da cellule specializzate come i macrofagi (D). In assenza di apoptosi la cellula difettosa rimane libera di esprimersi e replicarsi.
Ma facciamo un salto indietro e ritorniamo al 1984, quando i ricercatori che stavano identificando il danno genetico generato dalla t(14;18) videro che questo influiva sulla corretta espressione del gene BCL-2 (B-cell lymphoma 2). Poco dopo l’alterazione venne osservata anche nella Leucemia Linfatica Cronica (LLC), indipententemente dalla presenza della t(14;18). Ulteriori ricerche contribuirono a rendere ancora più interessante BCL-2: sembrava esistere una diretta casualità tra la sua alterazione e l’insorgenza di neoplasie. La svolta avvenne nel 1992, quando fu evidente che le cellule in cui BCL-2 era sovraespresso acquisivano una resistenza all’azione di ogni chemioterapico utilizzato all’epoca.
Malgrado fosse ormai evidente il ruolo fondamentale di Bcl-2 nello sviluppo del tumore, i ricercatori non avevano affatto chiaro come agire per contrastarne gli effetti.
Essendo la proteina localizzata all’interno della cellula si tentò di inattivarla bloccandone precocemente lo sviluppo. Un farmaco diretto contro il suo RNA messaggero (mRNA) arrivò fino alla terza fase di ricerca clinica ma l’americana Food and Drug Administration (FDA, l’ente regolatore per il farmaco) valutò infine che non esistevano sufficienti benefici terapeutici per autorizzarne la commercializzazione.
Nonostante l’insuccesso commerciale, lo sforzo si rivelò molto utile dal punto di vista scientifico perché i dati fin lí raccolti rafforzarono la convinzione che il bersaglio su cui puntare era quello corretto.
I ricercatori a quel punto modificarono la strategia di attacco alla proteina con un solo obiettivo: isolarla. Si concentrarono su quale fosse il modo migliore per impedirle di interagire con altre unità e nel 2005 venne prodotta una prima molecola che, seppure efficace, nel 2011 venne abbandonata a causa di effetti collaterali difficili da gestire. Altri due anni di ricerche furono necessari per creare una nuova molecola i cui studi fornirono risultati di tale eccezionalità da convincere la FDA a rilasciare ben tre autorizzazioni prioritarie.
E’ in particolare nel trattamento della Leucemia Linfatica Cronica che la molecola dimostra tutta la sua potenzialità. L’azione è talmente potente che i medici si trovano a dover gestire un effetto collaterale causato dalla massiva distruzione delle cellule tumorali. Un ultimo sgarbo della malattia.
Il resto è storia di questi giorni, in uno scenario dove la ricerca procede a passo spedito anche in Italia, aiutata dalla consapevolezza di poter forse contrastare, per la prima volta, una delle sei caratteristiche fondamentali che definiscono una cellula tumorale come tale: la resistenza alla morte cellulare programmata.
- Evita la morte cellulare programmata (apoptosi)
- Si moltiplica autonomamente (ignorando i meccanismi regolatori della proliferazione cellulare);
- Stimola la formazione di capillari per procurarsi il nutrimento;
- Si può allontanare dal tessuto originale;
- Può proliferare in aree differenti da quella originale.
- Può superare le barriere, invadere tessuti circostanti, entrare nel circolo sanguigno e linfatico;